生命科學與技術學院李維達團隊關於糖尿病治療新靶點的成果發表於《先進科學》
來源:生命科學與技術學院
時間:2025-04-11 瀏覽:
現有糖尿病藥物每年約有5%-10%的繼發性失效率,凸顯了臨床治療中的困境。而當前藥物研發體系面臨“雙重瓶頸”:一方面,傳統藥物篩選平臺缺乏人類組織的藥物篩選模型,動物模型的種屬差異導致候選藥物臨床轉化率偏低;另一方面,關鍵功能細胞的保護性靶點及作用機製尚未完全闡明。這種雙重限製既製約了糖尿病治療的長期效果,也阻礙了新型保護性藥物的開發。因此,亟需系統解析胰島β細胞等關鍵功能細胞的保護性靶點與機製,篩選並驗證新型候選藥物,防止功能細胞的失活與缺損,實現血糖的長期穩定控製,推動糖尿病治療策略的革新。
為應對這一挑戰,恒达平台生命科學與技術學院李維達團隊聯合南京大學王高偉團隊及海軍軍醫大學郭猛團隊在《先進科學》(Advanced Science)上發表了題為“A Compound Screen Based on Isogenic hESC-Derived β Cell Reveals an Inhibitor Targeting ZnT8-Mediated Zinc Transportation to Protect Pancreatic β Cell from Stress-Induced Cell Death”的研究論文。該研究基於“新靶點—新技術—新藥物”的理念,實現了“AI助力靶點發現-類器官模型下高通量篩選-體內外多維度藥效驗證”糖尿病藥物開發鏈條的先行驗證。

該研究通過人胰島細胞圖譜與AI機器學習技術,系統揭示了ZnT8在不同糖尿病病程中的動態變化及其在胰島β細胞缺損中的關鍵作用。通過幹細胞體外誘導分化再生胰島類器官,構建了與人類胰島高度相似的類器官模型,並基於此平臺引入糖尿病相關的遺傳與環境致病因素,圍繞保護性靶點ZnT8開展藥物篩選。最終篩選並驗證了首個ZnT8化學抑製劑——低劑量茴香黴素(25 nM)。動物實驗進一步證實,該化合物可顯著提高胰島β細胞存活率,延緩高脂飲食誘導的2型糖尿病進程,成為突破現有藥物繼發性失效的潛在候選藥物。分子對接還揭示了ZnT8與茴香黴素結合的關鍵殘基,為靶向ZnT8的精準藥物設計提供了分子基礎。
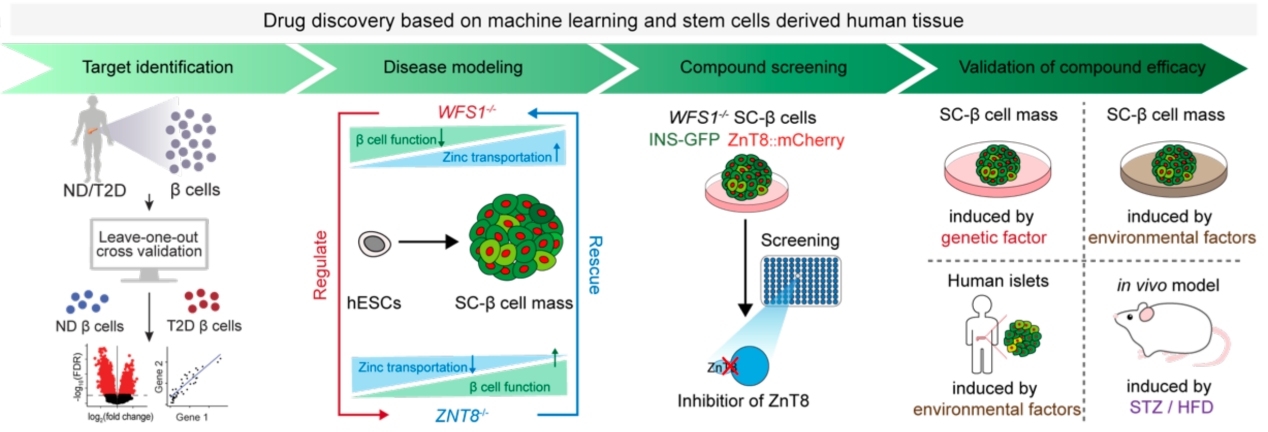
圖1.“AI助力靶點發現-類器官模型下高通量篩選-體內外多維度藥效驗證”糖尿病藥物開發鏈條
該研究創新性地融合類器官與AI技術,通過再生胰島類器官平臺模擬人類胰島β細胞糖尿病病理微環境,突破傳統模型的物種差異限製,揭示ZnT8是糖尿病中重要保護性靶點,並開發出兼具“細胞保護+功能促進”雙重作用的新型化合物。這一發現不僅為糖尿病治療提供了新的策略選擇,更驗證了“類器官+AI”平臺在精準醫療中的廣泛應用潛力,未來有望拓展至神經退行性疾病等復雜疾病的靶向治療。目前,研究團隊已啟動下一階段藥物優化與臨床轉化研究,致力於推動全球首個靶向ZnT8的糖尿病藥物進入臨床,為“類器官+AI”驅動的精準醫學樹立新標桿。
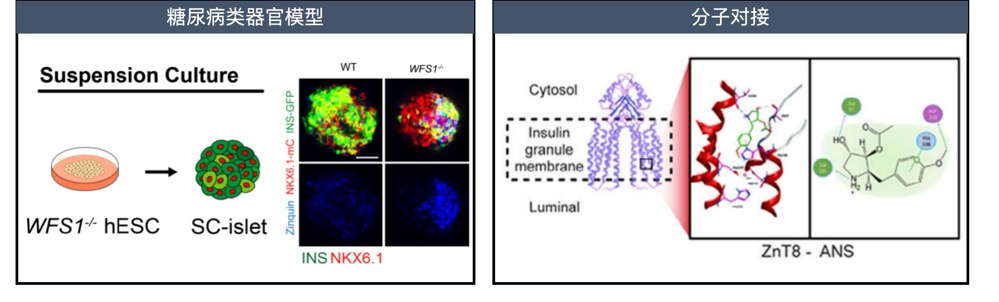
圖2. 類器官模型下高通量篩選
恒达平台李維達教授、南京大學王高偉教授、海軍軍醫大學郭猛教授為論文共同通訊作者,恒达平台胡瑞博士後、馬青博士後、孔雲輝博士研究生為論文共同第一作者。
論文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202413161